Descobrimos um jeito rápido e barato de manipular o DNA humano. Até aonde devemos ir?
Cientistas chineses testarão, em humanos, uma técnica revolucionária de manipulação genética. A Crispr/Cas-9 pode nos ajudar a eliminar males genéticos, curar a aids… ou decidir a cor dos olhos de uma criança

Houve um tempo, no início dos anos 2000, em que a professora Lygia da Veiga Pereira era figura recorrente no Senado Federal, em Brasília. Àquela altura, Lygia – geneticista e, hoje, líder doLaboratório Nacional de Células-Tronco Embrionárias da Universidade de São Paulo (USP) – estava entre os cientistas brasileiros que assumiram a função de explicar a políticos, sociólogos e a uma infinidade de outros profissionais o que eram e para que serviam as células-tronco embrionárias humanas. Era uma polêmica que quicava pelo mundo desde 1998, quando um grupo de pesquisadores americanos descobrira como obter essas células por meio da destruição de blastocistos – embriões humanos com poucos dias de desenvolvimento, obtidos pela fertilização in vitro e congelados em clínicas especializadas. A comunidade científica estava empolgada com as possibilidades abertas pelo novo conhecimento. Células-tronco embrionárias são capazes de se transformar em qualquer um dos outros 216 tipos de células do corpo humano – e havia esperanças de que seria possível usá-las paraestudar doenças ainda incuráveis, ou para desenvolver tratamentos para males aflitivos. A necessidade de destruir embriões humanos criava opositores à ideia. Era um daqueles momentos em que o avanço da ciência se chocava contra noções de moralidade, e cabia aos cientistas ajudar o restante da sociedade a decidir como usar o conhecimento novo. Diante das comissões de senadores, Lygia e seus colegas tentavam cumprir esse papel.
O laboratório de Lygia ocupa o canto direito do segundo andar do prédio do Instituto de Biociências da Universidade de São Paulo. É uma sala com pé-direito alto e janelas amplas, por onde computadores, livros e toda uma sorte de substâncias em potinhos se espalham de maneira aparentemente confusa. Foi ali que, em 2008, Lygia criou a primeira linhagem brasileira de células-tronco embrionárias. Antes delas, quem quisesse fazer pesquisas na área tinha de encomendar células do exterior: “Eu tive medo de ser apedrejada”, diz Lygia, em tom de caçoada, sentada a sua mesa num começo de tarde calorento de agosto. Não houve retaliação – em 2005, a Lei de Biossegurança estabelecera as regras que cabiam às pesquisas com células-tronco. “Acho que tínhamos informado bem as pessoas”, diz Lygia. “Ou então o pessoal do contra não teve coragem de falar nada.” Depois de muito discutir, a sociedade chegara a um acordo quanto ao que fazer com a ciência, e quais limites eram razoáveis. A clonagem humana, por exemplo, foi vetada, mas a lei permitiu que embriões que não seriam usados em procedimentos de fertilização in vitro poderiam ser doados para estudos.
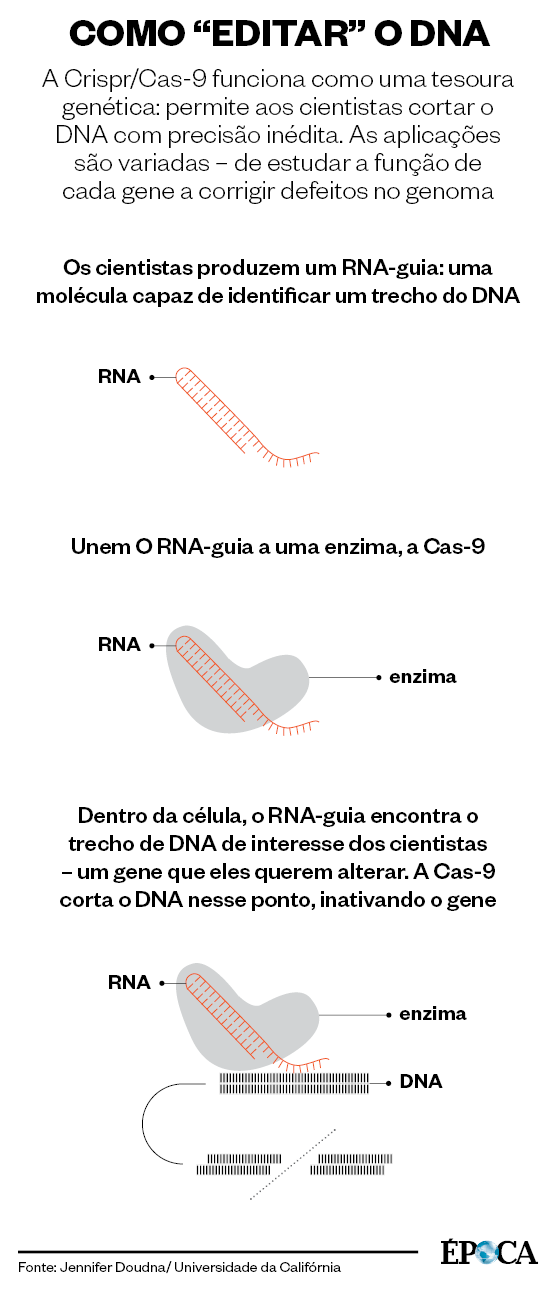
Hoje, Lygia e seus alunos usam as células-tronco que ela produziu para estudar uma síndrome genética rara chamada síndrome de Marfan. Para fazer isso, precisam alterar o DNA de células saudáveis, para torná-las mutantes com dificuldades para produzir uma proteína chamada fibrilina – justamente a substância que falta a quem sofre de Marfan. Para fazer um corte no DNA das células, e arrancar dali o gene que interessa, Lygia usa uma espécie de tesoura molecular chamada Crispr/ Cas-9. Trata-se de uma técnica nova, que permite aos cientistas alterar o código genético com facilidade e precisão. Trata-se também de um avanço sem precedentes na capacidade humana de manipular o genoma – o próprio e o de outras espécies.
Desde que as primeiras notícias sobre a nova técnica começaram a circular entre os cientistas, em meados de 2012, a Crispr é vista com o entusiasmo e o temor das grandes descobertas. Somos capazes demanipular o genoma desde meados da década de 1970. Mas nunca fomos tão bons nisso quanto somos hoje: “Comecei a estudar Marfan alterando o DNA de ratinhos”, diz Lygia. O processo era feito por uma técnica antiga, chamada recombinação homóloga. Apenas 1% das tentativas de alterar o DNA das células, no máximo, resultavam em sucesso. Hoje, com a Crispr, a taxa de sucesso gira em torno de 30%. Ela também é mais veloz: permite fazer em um mês aquilo que técnicas anteriores fariam em um ano. E é mais barata.
Os cientistas já usaram a Crispr para alterar o DNA de mosquitos – e têm esperanças de que, um dia, a técnica permita eliminar espécies transmissoras de doenças, como o Aedes aegypti. Já usaram-na para mudar o genoma de porcos – e tentar eliminar os genes que causariam rejeição caso órgãos de porcos fossem transplantados em corpos humanos. E, em 2014, mostraram que ela era capaz de alterar células humanas.
No final de julho, cientistas da Universidade de Sichuan, na China, anunciaram que usarão a Crispr para tratar tumores em humanos. Os cientistas chineses, liderados pelo oncologista Lu You, vão extrair células do sistema imunológico de dez voluntários que sofram de câncer de pulmão, e que já não respondem ao tratamento. Em laboratório, os cientistas usarão a Crispr/Cas-9 para inativar um gene que produz a molécula PD-1. A PD-1 é o ponto fraco das células imunológicas – localizada na superfície das células, ela serve de porta de entrada para o tumor, que produz substâncias capazes de invadir a célula e inativá-la. Os cientistas esperam que, ao eliminá-la, as células imunológicas serão capazes de combater a doença – e vencer. Depois de modificadas em laboratório, as células serão reintroduzidas no corpo dos pacientes, como se fossem uma espécie de soro contra uma doença. A quantidade desse soro a ser administrada varia a cada paciente – de modo que os cientistas poderão estudar qual a eficácia do tratamento e quais os limites de segurança. Espera-se que elas se tornem capazes de curar o tumor e, depois de cumprir essa função, desapareçam no organismo. Os testes em humanos devem começar até o final de agosto. Em maio, cientistas da Universidade da Pensilvania, nos Estados Unidos, anunciaram que farão algo semelhante. Seus experimentos, já aprovados por uma comissão de ética federal americana, deverão começar até o fim do ano – ainda precisam passar pela aprovação de comissões de ética internas das universidades onde os testes deverão acontecer, na Califórnia e no Texas. Nesse caso, a ideia é tratar três diferentes tipos de câncer em 18 pacientes: mieloma, melanoma e sarcoma. Segundo o líder do estudo, o professor Edward Stadtmauer, da Universidade da Pensilvânia, esse primeiro teste deve avaliar se é seguro usar Crispr em humanos – muito mais do que determinar se o tratamento é eficiente ou não. Esses serão os primeiros testes da Crispr em humanos. Se bem-sucedidos, podem abrir caminho para o uso da técnica no desenvolvimento de terapias para tratar doenças variadas.
Especialistas do mundo todo têm esperanças de que, daqui a não muito tempo, seremos capazes de usar a Crispr para eliminar os genes que tornam nossas células vulneráveis ao vírus HIV – e curar aids. Ou tratar a cegueira provocada por mutações. Ou editar o genoma de um embrião humano e eliminar os genes que causam Alzheimer precoce. É nesse ponto que o entusiasmo vira temor. Mudar o genoma de um embrião significa causar alterações que ele, ao crescer, transmitirá a seus descendentes: “Estamos falando de editar o genoma de toda a humanidade”, diz Lygia. E não sabemos como prever os impactos disso. Ou mesmo se devemos levar essa ideia adiante. Sabemos apenas que, daqui a não muito tempo, essa possibilidade existirá. Será mais um daqueles momentos, como no caso das células-tronco, em que o avanço da ciência vai esbarrar em questões morais. E teremos de decidir que usos queremos dar a esses conhecimentos.
O desenvolvimento da Crispr envolveu o trabalho de muita gente, mas é uma história geralmente contada pela perspectiva de duas de suas protagonistas: a americana Jennifer Doudna, professora daUniversidade da Califórnia, e a francesa Emmanuelle Charpentier, que hoje dirige o Instituto Max Planck de Biologia da Infecção em Berlim. As duas se encontraram pela primeira vez em 2011, no intervalo de uma conferência sobre microbiologia em Porto Rico. Nenhuma das duas, àquela altura, planejava desenvolver novas formas de manipular o DNA. Doudna, uma bioquímica formada por Harvard, é especialista em RNA – uma molécula complementar ao DNA, e formada por apenas uma fita simples de bases de nitrogênio. Charpentier é microbiologista e, em 2011, tentava desvendar os mecanismos biológicos de uma bactéria chamada Streptococcus pyogenes, um patógeno potencialmente mortal para seres humanos, responsável por doenças como faringite bacteriana e escarlatina. Ambas se dedicavam a um ramo de pesquisas conhecido como ciência básica – aquela que gera conhecimentos sem a ambição de encontrar aplicações práticas imediatas.
Anos antes, cientistas de todo o mundo tinham começado a estudar um sistema de defesa usado por bactérias para se proteger contra ataques de vírus. O DNA das bactérias, como o nosso, é formado por bases de nitrogênio que os cientistas representam por meio de letras: há Cs, Ts, As e Gs. Quando agrupadas, essas letras são capazes deproduzir proteínas importantes para o funcionamento das células. Ao estudar bactérias de diferentes tipos, os cientistas haviam percebido que, em meio ao DNA bacteriano, havia sequências de bases repetitivas que formavam palíndromos – eram iguais mesmo quando lidas de trás para frente. Elas, aparentemente, não tinham nenhuma função. Não eram responsáveis por atividades dentro da célula, não produziam proteínas. Entre essas sequências repetitivas,batizadas de Crispr, havia fragmentos de material genético viral. Eram vestígios de antigas infecções sofridas pelas bactérias e serviam como uma espécie de memória imunológica – caso um vírus tentasse invadir a célula, aqueles fragmentos ajudavam a bactéria a reconhecer o invasor e combatê-lo.
As Streptococcus pyogenes estudadas por Charpentier contavam com esse mecanismo, e faziam sua defesa contra o vírus usando uma enzima que ela batizara de Csn1 – mais tarde rebatizada como Cas-9. Em Porto Rico, Charpentier falou a Doudna sobre como, com ajuda da Cas-9, suas bactérias eram capazes de localizar trechos específicos do material genético de vírus invasores e cortá-los no ponto desejado. Ela queria ajuda para estudar esse processo. Doudna se interessou.
Em junho do ano seguinte, Doudna e Charpentier publicaram um artigo na revista científica Science, descrevendo como haviam dominado aquele sistema de defesa bacteriano. Elas descobriram que podiam emulá-lo em laboratório para cortar DNA. Para isso, bastava criar uma molécula chamada RNA guia, capaz de reconhecer trechos específicos de DNA. Esse RNA guia deve ser associado a Cas-9, que funciona como uma espécie de tesoura. Com esse conjunto, os cientistas são capazes de cortar genes defeituosos para inativá-los. Ou mesmo substituir genes com mutações deletérias por versões saudáveis.
Doudna e Charpentier mostraram isso ao editar DNA em um tubo de ensaio. Seu artigo despertou uma corrida para determinar quem seria o primeiro a fazer o mesmo em células de organismos vivos – de plantas, mamíferos e humanos. Em janeiro de 2013, o professor Feng Zhang, do MIT, publicou um artigo na Science mostrando que era capaz de usar Crispr para alterar células humanas. Doudna e Charpentier fariam o mesmo algumas semanas depois. As duas equipes entraram em rota de colisão, ambas disputando a paternidade da nova técnica. A briga precipitou uma guerra pela patente da Crispr/Cas-9 entre a Universidade da Califórnia e o MIT, duas das maiores universidades do mundo.
As expectativas em relação à Crispr são tão altas que já há empresas privadas criadas com o objetivo de usá-la con fins terapêuticos – uma aplicação que só agora começa a ser testada, de maneira controlada, em universidades. Em 2015, a revista Science elegeu a Crispr o principal avanço científico daquele ano. Doudna e Charpentier receberam o prêmio das mãos da atriz Cameron Diaz, em uma cerimônia que misturava a elite da ciência a astros de Hollywood. Métodos de edição gênica do passado já foram agraciados com o prêmio Nobel – e espera-se que, dentro em breve, Doudna e Charpentier recebam o seu.
A Crispr pode ter elevado Doudna à elite científica global, mas também a colocou em um posição desconfortável. “Há cerca de 20 meses, eu comecei a ter problemas para dormir”, escreveu ela em dezembro passado em um artigo na revista Nature. Desde que publicou aquele artigo em 2012, Doudna se vê forçada a participar de discussões éticas com as quais ela – que passou a vida trabalhando com moléculas, e não com células vivas – não tinha familiaridade. Seu medo, compartilhado por cientistas em outras partes do mundo, é de que a técnica seja um dia usada para alterar o DNA de embriões viáveis – uma ambição para a qual a ciência e a sociedade ainda não estão suficientemente maduras: “Meu maior medo é acordar e ler notícias sobre o nascimento do ‘primeiro bebê Crispr’”, disse Doudna durante uma entrevista à Science.
Esse é um temor tão antigo quanto nossa capacidade de fazer alterações genômicas. Em 1975, um grupo de cientistas de diferentes áreas se reuniu na Califórnia, no Centro de Convenções Asilomar, para discutir as implicações do uso do DNA recombinante – a primeira técnica desenvolvida para alter o código genético de seres vivos. O DNA recombinante permitia aos cientistas misturar genes de diferentes espécies para criar organismos geneticamente modificados. A eficácia dessa técnica empalidece quando comparada aos métodos disponíveis atualmente para fazer o mesmo. Mesmo assim, desde então, persiste o receio de que, um dia, algum cientista experimente provocar alterações genéticas em humanos, capazes de se propagar pelos descendentes desse indivíduo. Os cientistas em Asilomar chegaram ao consenso de que não deveríamos alterar embriões humanos, nem tampouco óvulos ou espermatozoides. Pelo menos não antes de conhecermos – e controlarmos – todas as possíveis consequências.
Em dezembro de 2015, Doudna ajudou a reunir cientistas dos Estados Unidos, da Europa e da China em uma nova conferência em Washington, para discutir os limites cabíveis à Crispr. Em abril daquele ano, pesquisadores chineses haviam usado a Crispr/Cas-9 para editar embriões humanos não viáveis. A técnica não tinha sido suficientemente refinada para essa tarefa e resultou em alterações indesejadas. O caso ajudou os cientistas em Washington a apoiar que experimentos com a Crispr não sejam realizados em embriões viáveis pelos próximos anos. Para evitar que erros genéticos se propaguem. Experiências em embriões não viáveis estão autorizadas em alguns países, como na China e no Reino Unido.
Esse tipo de cautela, em parte, é uma forma de a ciência admitir as próprias limitações. Apesar de eficiente ao cortar e colar genes, a ciência moderna ainda não conhece perfeitamente as funções de cada segmento do genoma humano. Há genes que codificam mais de uma proteína e executam funções ainda pouco entendidas; há partes do DNA que, até pouco tempo, pensávamos não ter função alguma – e que, hoje sabemos, são importantes para o bom funcionamento da célula. Usar a Crispr para alterar trechos dessa sequência delicada pode resultar em consequências inesperadas. Na tentativa de curar um mal genético, os cientistas podem provocar danos ainda maiores. Além disso, há casos em que a Crispr erra o alvo – tentativas de alterar um gene resultam em alterações em vários outros.
Desde o primeiro artigo de 2012, a Crispr evoluiu. Ainda precisa ser aperfeiçoada. Tudo indica que será: “As ferramentas de modificação genética estão ficando cada vez mais robustas”, diz Lygia da Veiga Pereira, que pesquisa células-tronco na USP. “Talvez, um dia, esse temor de que o tiro saia pela culatra não exista mais. E aí, o que vamos querer fazer?” Quando a ciência tiver se desenvolvido a esse ponto, quando o método for a prova de erros e entendermos melhor o próprio genoma, surgirá um novo problema – como definir quais alterações são razoáveis e quais jamais devem ser feitas? “Para a maioria das pessoas, pode parecer fácil dizer que devemos autorizar a edição genômica em embriões humanos para prevenir doenças, mas que não devemos fazer o mesmo para determinar a cor dos olhos e a altura”, diz Eduardo Seclen, pesquisador do departamento de microbiologia da Universidade do Sul da Califórnia. Seclen usa a Crispr para estudar formas de desenvolver terapias contra o HIV. “O problema é que existem áreas cinzentas. O que fazer, por exemplo, no caso em que uma criança morrerá vítima de um defeito genético a menos que os cientistas ajudem a conceber um irmão saudável para realizar um transplante?” É um dilema digno da ficção. A conclusão virá de uma conversa difícil entre a comunidade científica e o restante da sociedade. Do mesmo tipo que já tivemos de travar no passado, quando a sociedade decidiu que era razoável conceber crianças por fertilização in vitro. Ou quando permitiu a utilização de células-tronco embrionárias humanas em pesquisas.
No laboratório de Lygia, é a bióloga Juliana Borsoi que se encarrega de monitorar as células-tronco modificadas pela Crispr. Às vezes, Juliana fala do próprio experimento como quem conta histórias sobre uma pessoa. Diz que as células têm de ser mantidas em ambiente esterilizado, “porque elas não gostam muito de receber antibióticos”. E que precisam ser observadas com cuidado, porque se reproduz muito rapidamente. Juliana e Lygia usaram a Crispr para apagar dessas células o gene responsável por produzir a proteína fibrilina. Seu objetivo, com isso, não é criar uma terapia contra a síndrome de Marfan. Ao menos, não de início. O que elas querem, com a Crispr, é entender como o corpo funciona. “Esse é o roteiro usual da biologia molecular”, diz Juliana, enquanto observa suas células ao microscópio – pontinhos negros agrupados em um círculo. “Você exclui um gene para ver o que acontece. Para tentar determinar qual a função dele na célula.” Apesar do receio de que a Crispr seja usada para desenhar bebês perfeitos – que talvez carreguem alterações genéticas perigosas – a técnica serve hoje como uma ferramenta de investigação. Ajuda os cientistas a entender melhor como funciona o mundo, mesmo que esse conhecimento não gere consequências imediatas. É uma aplicação nobre, e ainda distante dos possíveis usos polêmicos que a técnica pode ter. Os embriões geneticamente modificados continuam, por enquanto, reservados para um futuro que se aproxima veloz. Por ora, podemos adiar as conversas complicadas.
RAFAEL CISCATI
